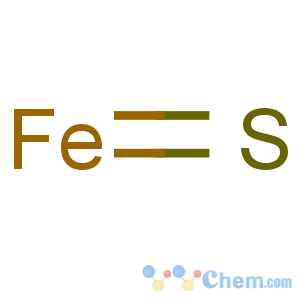硫化亚铁
硫化亚铁的化学式为FeS,

硫化亚铁
硫化亚铁为黑褐色六方晶体 难溶于水。可由硫和铁在高真空石英封管内共熔而得,反应方程式为Fe+S→ FeS(条件为加热)。这样制得的硫化亚铁作为化学试剂成本较高,而化学纯试剂硫化亚铁含杂质较多。
硫化亚铁的化学性质
化学试剂的贮存纵然密封也要和空气接触,在空气中有微量水分存在下,硫化亚铁逐渐氧化成四氧化三铁和硫,化学方程式如下:3FeS+2O2=3S+Fe3O4。用硫化亚铁与稀盐酸或稀硫酸反应制硫化氢气体时,由于是在启普发生器或其简易装置中制备,硫化亚铁固体表面的氧化层中的硫不与稀盐酸、稀硫酸反应,阻碍了硫化亚铁与酸液中的氢离子接触(即硫化亚铁虽然难溶,但毕竟能溶解一点点,溶解的部分完全电离出亚铁离子与硫的阴离子。)此时溶液中几乎无硫阴离子,与氢离子结合生成弱电解质硫化氢就很少。另一方面在常温下四氧化三铁与稀盐酸、稀硫酸反应比较慢,溶解四氧化三铁还会消耗较多的氢离子,使氢离子浓度下降,发生反应的化学方程式Fe(FeO2)2+8H+=Fe2++2Fe3++4H2O。
反应速率慢而又不能加热因此不能制取硫化氢气体,必须对硫化亚铁固体进行预处理以除去表面的氧化层。
对硫化亚铁表面的氧化层溶解可用1∶1的盐酸加热以溶解表面的四氧化三铁成可溶的铁盐、亚铁盐后,附着在硫化亚铁表面的硫附着力减弱,随着溶液沸腾时因固体的跳动,硫会脱离硫化亚铁表面。然后将硫化亚铁固体取出、冲洗,就可得到较纯的呈凸凹状的硫化亚铁固体。
对已除去氧化层的硫化亚铁放置时间不能太长,以实验前一天处理氧化层后备用。贮存方法:不能放在试剂瓶中,因为它极易氧化;而可以用聚乙烯塑料薄膜包裹紧,为防薄膜破损可再加一层薄膜包裹,以防其与空气接触而氧化。
在制备硫化氢气体时,为了符合演示实验要求,可用温热的稀硫酸与硫化亚铁固体在启普发生器的简易装置中进行反应(用盐酸制备硫化氢时会使硫化氢中混有氯化氢气体),这样收集的硫化氢气体用来做其性质实验,如水溶液的酸性、与硫酸铜溶液的反应、点燃硫化氢等实验时现象才明显。
S为-2价Fe为+2价
化学反应式
单质铁和硫密闭高温反应会生成硫化亚铁。
Fe+S→FeS(实验室制取)
和氢氧化钠反应
FeS+NaOH→Na2S+Fe(OH)2↓
自然界的硫化亚铁以磁黄铁矿的形式存在。它有单斜和六方两种,都为非计量化合物,缺少铁原子,化学式大约为Fe7S8。
硫化亚铁是反铁磁性的,难溶于水,但可溶于酸放出硫化氢气体
FeS + 2 HCl→ FeCl2 + H2S↑
H2SO4+FeS→FeSO4+H2S↑ (实验室制取硫化氢)
真空加热至1100 °C时,硫化亚铁开始分解。